Motivar el diseño y desarrollo de ambientes de aprendizaje dentro y fuera del salón de clase es el objetivo a priori de la enseñanza.
Osman Villanueva García
Ingeniera Química Industrial, egresada del IPN. Experiencia en la industria farmacéutica y en la industria de los cosméticos.
Docente en el IEMS, Colegio de Bachilleres de Estado de México, CONALEP y CCH.
Libros:
Colaboradora en los libros de Química 1 y Química 2 del sistema semiescolarizado del IEMS.
"Todos somos química"
El objetivo de este grupo es conocer lo interesante y maravilloso de la relación que mantiene la química con todos los seres humanos en los distintos aspectos de su vida.

¡Ven, intégrate al grupo y descubre el Maravilloso Mundo de la Química!
sólo da clic en Unirse
facebook: Química Miguel Hidalgo | Facebook
Utiliza este Hashtag para compartir
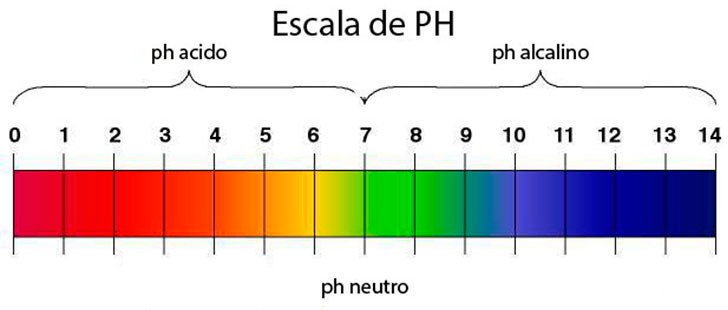
Los ácidos y las bases son sustancias que se encuentran presentes en nuestra vida diaria ya que se encuentran en los alimentos, en nuestro organismo, en los productos de belleza, en productos para la limpieza, en los medicamentos, en las bebidas, etc., pero ¿cómo podemos saber si tal producto es un ácido o es una base?. Una forma sencilla es consultando escalas de clasificación de productos de acuerdo a su pH y eso resuelve de inmediato nuestra duda.

Sin embargo para llegar a la construcción de estas escalas se requirió de la aplicación de todo un procedimiento que abarcó desde la parte experimental hasta llegar al cálculo matemático.
CALCULANDO EL pH y pOH
Al hablar de ácidos o bases es importante que recuerdes que estas sustancias tienen tanto iones [H+] como iones [OH-], así que el que se clasifiquen en ácido o en base dependerá de que tipo de iones se encuentran en mayor proporción en las sustancias. Sí hay mayor cantidad de iones [H+] será un ácido , si por el contrario hay mayor cantidad de iones [OH-] entonces se tratará de una base.
Por ejemplo cuando una sustancia tiene un pH=13 significa que la concentración de iones hidrógeno [H+] es muy escasa (1x10-13= 0.0000000000001) y que predomina la concentración de iones hidróxido [OH-] (1x10-1=0.1) por lo que la sustancia es muy básica.
¿Cómo saber qué iones están en mayor cantidad?. Se requiere hacer cálculos y para comenzar a realizar cálculos es necesario tener presentes las ecuaciones (Tabla 1) que serán de gran utilidad:
Tabla 1. Fórmulas para el cálculo de pH
|
1 [H+] X [OH-] = Kw |
2 Kw = 1X10-14 |
3 pH= -log([H+]) |
4 pOH = - log([OH-]) |
5 pH + pOH = 14 |
Donde:
[H+] = Concentración de iones Hidrógeno (Hidronio) en mol/l
[OH-] = Concentración de iones Oxhidrilo o Hidroxilo en mol/l
Kw = Constante de ionización del agua
pH = Potencial de Hidrógeno
pOH = Potencial de Hidróxido
Con estas 5 fórmulas (Tabla 1) se pueden realizar los diferentes cálculos que se requieren para determinar el pH y pOH de una solución, sin embargo en esta ocasión sólo nos vamos a referir a las fórmulas 3, 4 y 5. El uso de cada una de ellas o en algunos casos la combinación del uso de ellas, dependerá de lo que se solicite en cada uno de los diferentes ejercicios. Esto se puede ver en los diferentes ejemplos que se dan a continuación (recuerden tener presente la clasificación de la escala de pH y la Teoría de Arrhenius ácido-base).
EJERCICIOS:
1) Determina si una solución es ácida o básica, sí la concentración de iones [H+] es 3 X10-3 mol/l.
Primero debemos determinar el pH de la solución con la concentración proporcionada:
|
Datos |
Fórmula |
Sustitución |
|
pH = ? [H+] = 3 X10-3 mol/l. |
Para calcular el pH sí revisas en la Tabla 1 se tienen la fórmula 3 y 5. Se va a utilizar la fórmula 3 porque como está indicado en los datos, se conoce la concentración de los iones Hidronio [H+] . pH= -log([H+]) Aclaración: La fórmula 5 no se puede utilizar porque si la revisas te darás cuenta que se necesita conocer al pOH para poder calcular al pH mediante un despeje, pero no nos dan el dato del pOH, por esa causa no se puede utilizar esa fórmula. |
pH= -log(3 X10-3) pH = -(-2.52287875) pH = 2.52 ** |
Una vez que se conoce el pH de la solución y conociendo la división de la escala del pH , podemos determinar que la solución es ácida porque tiene un pH= 2.52 **
2) Señala cuál es el pH de una solución cuyo pOH es de 4.6.
|
Datos |
Fórmula |
Sustitución |
|
pH = ? pOH= 4.6 |
Para calcular el pH sí revisas en la Tabla 1 se tienen la fórmula 3 y 5. Se va a utilizar la fórmula 5 porque como se marca en los datos se conoce al pOH y mediante un despeje se puede calcular al pH pH + pOH = 14 Despejando: pH= 14- pOH Aclaración: La fórmula 3 no se puede utilizar, porque sí la revisas te darás cuenta que se necesita conoce la concentración de los iones Hidronio [H+] pero ese dato no es proporcionado, por esa causa no se puede utilizar esa fórmula. |
pH= 14 – 4.6 pH = 9.4 |
3) Calcular el pH y el pOH de una solución de NaOH al 0.75 M.
En este problema nos hablan de una solución de NaOH, es decir que se trata de una base porqué de acuerdo a la Teoría de Arrhenius sí en la fórmula hay OH se trata de una base, que al disociarse en agua formará iones hidroxilo [OH-] y la concentración de estos iones es la que se señala en el enunciado del problema con un valor de 0.75 mol/l. Una vez hecha estás aclaraciones procedamos a resolver:
|
Datos |
Fórmula |
Sustitución |
|
pH = ? pOH = ? [OH-] = 0.75 mol/l. |
Para calcular el pH y pOH sí revisas en la Tabla 1 se tienen la fórmula 3, 4 y 5. ¿ Cuál de ellas debes utilizar?, de acuerdo al dato que conocemos se debe empezar calculando el pOH con la fórmula 4, revisa que no podríamos empezar con ninguna de las otras porque no tenemos datos para poder hacer los cálculos. pOH= -log([OH-]) una vez que conocemos el pOH * ya se puede calcular el pH con la fórmula 5 realizando un despeje pH+pOH = 14 Despejando: pH= 14 - pOH |
pOH= -log(0.75) pOH = -(-0.12) pOH = 0.12 * pH= 14 – 0.12 pH = 13.88 |
4) Determina cuál es el pH de una solución de HF que tiene una concentración 0.009 M
En este problema se habla de una solución de HF, es decir que se trata de un ácido de acuerdo a la Teoría de Arrhenius que señala qué sí en la fórmula hay H se trata de un ácido que al disociarse en agua formará iones hidronio [H+] y la concentración de estos iones es la que se señala en el enunciado del problema con un valor de 0.009 mol/l. Una vez hecha estás aclaraciones vayamos a la resolución:
|
Datos |
Fórmula |
Sustitución |
|
pH = ? [H+] = 0.009 mol/l. |
Para calcular el pH sí revisas en la Tabla 1 se tienen la fórmula 3 y 5. Se va a utilizar la fórmula 3 porque como está indicado en los datos, se conoce la concentración de los iones Hidronio [H+] . pH= -log([H+]) Aclaración: La fórmula 5 no se puede utilizar porque sí la revisas te darás cuenta que se necesita conocer al pOH para poder calcular al pH mediante un despeje, pero no nos dan el dato del pOH, por esa causa no se puede utilizar esa fórmula. |
pH= -log(0.009) pH = -(-2.04) pH = 2.04 |
Entra al siguiente enlace para que tengas mayor claridad sobre el cálculo de pH y pOH : https://www.youtube.com/watch?v=mwYm8ZOgA98